2019年6月15日, 美国免疫学杂志(The Journal of Immunology, JI)封面论文报道了中国农业大学(CAU)博士生曲泽慧等论文:蝙蝠pMHC-I分子复合体的晶体结构及其结合高亲和力多肽的新机制(图 1)。该论文解析了蝙蝠(Pteropus alecto)MHC-I类分子复合体(pMHC-I)及多类突变体的精细结构,并根据一种新型多肽质谱分析手段对亨德拉,埃博拉等病毒的结合肽谱进行了预测。

图1. JI封面论文注释:CAU博士生曲泽慧等论文
首先,从蝙蝠pMHC-I结构中发现了一个特别的构象变化,即抗原结合槽左侧α1螺旋的向下翻转,这与已报道过的哺乳动物pMHC-I结构不同,结果如图2所示。 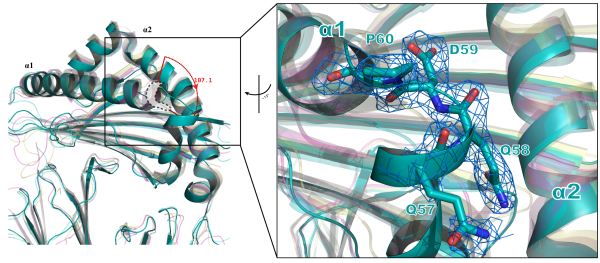
图2. 蝙蝠pMHC-I与已报道的哺乳动物pMHC-I分子复合体具有不同的构象 通过对蝙蝠pMHC-I的深入分析,发现该构象变化是由于插入的三个氨基酸所引起的,并且这种插入现象在蝙蝠中是普遍的,如图3所示。 
图3.蝙蝠pMHC-I中普遍的氨基酸插入现象(以紫色和绿色突出显示) 插入的氨基酸协助了酸碱氨基酸对(图3的黑框中)形成盐桥,并在结合肽的N-端与MHC-I 65位精氨酸之间形成了另一个盐桥。结果如图4所示。 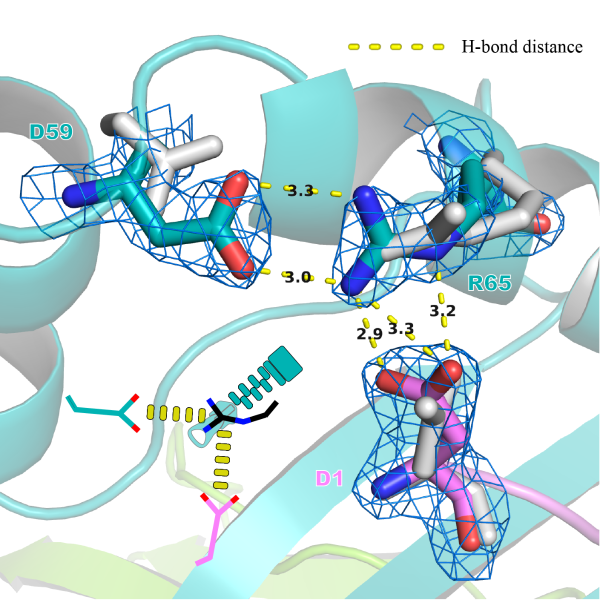
图 4. “盐桥链”(灰色的模型是插入氨基酸删除后的结构) 为了阐明这种“盐桥链”对于递呈多肽的影响,在合成随机九肽库以及质谱数据de novo分析方法的帮助下,创新性的设计了一种体外pMHC I结合肽组鉴定实验(图5)。 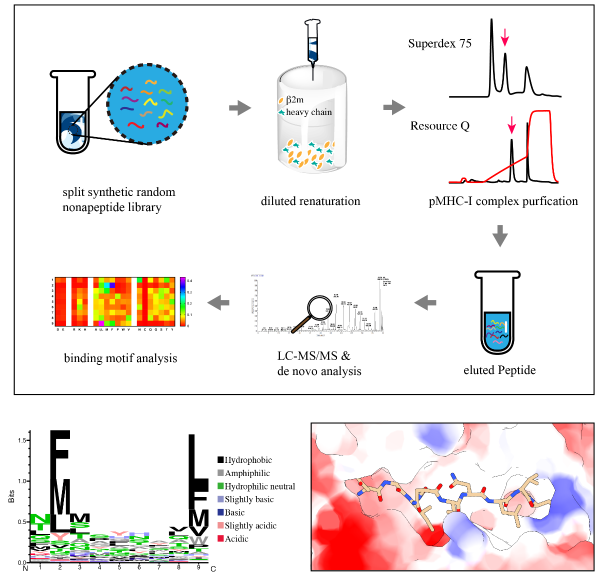
图5. 新引入的MHC-I结合肽组鉴定工作流程 蝙蝠pMHC-I的结构解析以及结合多肽质谱实验揭示了其呈递高亲和力多肽的新机制(图6)为蝙蝠细胞免疫多肽疫苗的设计提供了理论依据。 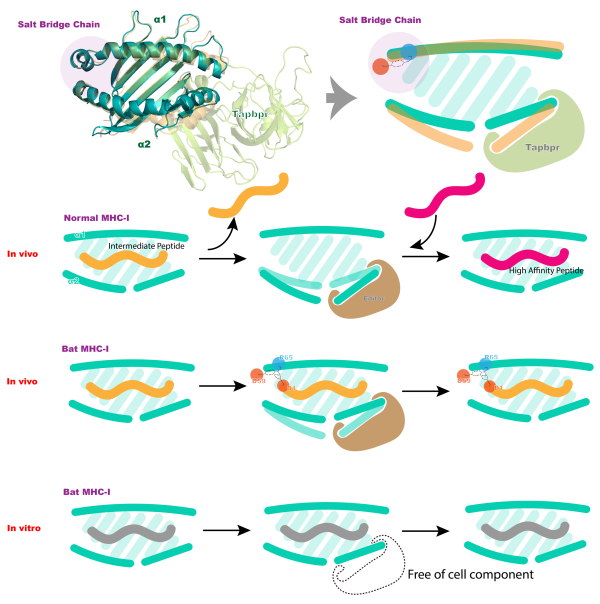
图6.蝙蝠MHC-I的肽交换过程 原文链接:http://www.jimmunol.org/content/202/12/3493 (J Immunol June 15, 2019, 202 (12) 3493-3506; DOI: https://doi.org/10.4049/jimmunol.1900001;第一作者为中国农业大学博士生曲泽慧、张念之副教授和夏春教授为本文的通讯作者。) |